No.3 プログラムされた細胞死の研究の黎明期
刀祢 重信 東京電機大学理工学部生命科学系
最近、研究室の卒研生に「細胞には自分が死ぬための遺伝子が備わっていて・・・」などと話していると、そんなこと当然知ってますみたいな顔をされてしまいました。細胞が死ぬ研究をしていると言ったら怪訝な顔をされた 40 年前と比べると、隔世の感を禁じ得ません。皆様のような世界的に著名な方々の書かれるエッセイと真逆の、細胞死研究の黎明期から細々とこの道を続けてきた 1 人の研究者の生き様を、若い方が反面教師としていただくために、徒然なるままに書かせていただきます。
化学工業界のトップ三菱化成(現三菱化学)が町田に作った、純粋に基礎研究のための生命科学研究所に研究員として運良く就職できた私は、発生生物学部長の加藤淑裕博士に、「細胞周期と細胞分化」に関係したことだったらどんなテーマを選んでもいいよ、と言われました。その頃、Howard Holtzer が提唱したQuantal Mitosis の言葉に象徴的に表されるように、発生現象における細胞周期、細胞分裂は、培養細胞におけるそれとは異なり、同じ繰り返しではなく、分化が起きるときや脱分化するときには、細胞周期が一旦停止したり、criticalな細胞周期が出現し、たった1回の細胞周期で、おそらくクロマチンのリモデリングが起きて遺伝子発現が激変するのであろうと考えられていました。実際に、ウニの発生等で、発生過程で細胞周期は刻一刻と変化するという論文が報告されていました。先輩の田中省二博士は、ニワトリ肢のウロコや羽毛の形態形成の系を用いて着実にこの問題を研究されていました。テーマとして眼の発生の系、造血系などを考えましたが、あるときEbertの発生の教科書をめくっていますと、肢芽におけるプログラム細胞死の図が眼に飛び込んできました。講義で習って知っていて面白いなあくらいの認識でした。もともと、死や老化には興味があり、いつかやってみたいとは思っていましたので、その現象を見直してみて、細胞がそんなに早い時期に死ぬ、しかもプログラムされているかのように決まったタイミングで死ぬということは、どういう仕組みでおきるのかと新鮮に感じたものです。そこでニワトリ胚の肢芽をナイルブルーで染色してみますと、見事に指間が顆粒状に染まりました。なんて美しいんだろう、そしてこの細胞たちは自分の死ぬべきタイミングを知っていて形作りに貢献していると感動したのを覚えています。1977年の春のことです。いろいろ文献を調べていくと、SaundersやFallonたちのグループが精力的に肢芽のPNZ, ANZと名付けられた部域の細胞死の実験発生学的研究や、タンパク質、核酸の細胞ごとの合成をオートラジオグラフィーで調べた論文を出しています。この時点でもPNZ, ANZ (posterior necrotic zone, anterior necrotic zone)の名称から窺えるように「ネクローシス」という認識です。Kerrらが「アポトーシス」の言葉を提案した論文(Kerr, Wyllie and Currie, Br.J. Cancer, 26, 239-257)が1972年ですから、私はアポトーシスの言葉も概念も知りませんでした。Fallonたちは、肢芽の細胞死の前に、RNA合成やDNA合成が低下し、少し遅れてタンパク合成が落ちて行くことを報告しています (Pollak RD, Fallon JF. Exp. Cell Res., 86, 9-14,1974, Pollak RD, Fallon JF, Exp. Cell Res., 100, 15-22, 1976)。Tataらはオタマジャクシのしっぽの退縮を器官培養法で再現し、タンパク合成、RNA合成の阻害剤で退縮が抑制されると報告しています (Tata JR, Dev. Biol., 13, 77-94, 1966 )。このことは細胞死に何らかの遺伝子発現、タンパク合成が必要であることを示唆しました。当時、多くのin vitro分化の系でチミジンのアナログのBrdUが分化を抑制するという報告が相次ぎました。
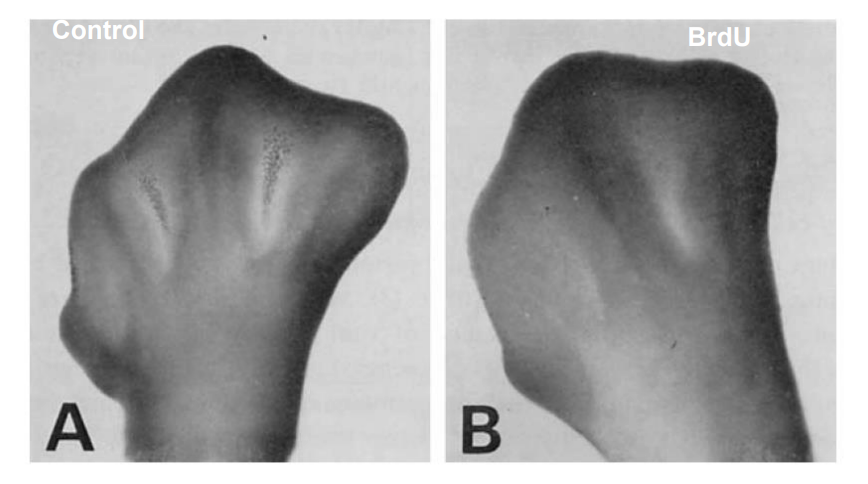
そこで思いついたのがもし細胞死も分化の1つならば、BrdUが抑えるのではないかということです。しかし、まだこの頃は細胞死のための特別の遺伝子がある、とまでは考えてはいませんでした。指間組織が死ぬ前後でS期を通る時期を調べたりしながら、いろいろな時期にニワトリ胚にBrdUを投与していきました。このBrdUの利点は、10倍量のチミジンを投与すると、その時点でBrdUの効果が打ち消せるということでした。そしてやってみますと、どうも効果がありそうです。ナイル青で染色しても、HE染色しても死細胞の数が激減していました。本来の研究の目的が細胞周期と細胞分化ですから、並行して細胞周期を解析していました。死ぬ予定の細胞たちは最後にS期を通ってからG2期で外れて死ぬようなのですが、面白いことにその最後のS期のときにのみBrdUが効果があるということが分かりました。もう1周前のS期では効果がありませんでした。心配なのは、BrdUの効果が細胞死を抑えたのではなく、発生の進行を抑えたからではないかということで、独自に設定した発生ステージ(指の伸長)や他の分化マーカーで発生自体は遅れていないことを確認しました。BrdU処理によって細胞死は激減しますが、M期やS期の細胞は有意に増加していることが分かりました。おそらく、G2期で細胞周期を外れずに次の細胞周期に入るために再びM期やS期を通過するからだと思います。そのまま細胞死を抑制させたまま発生を続けさせると、水かきを持つひよこが孵化しました (Toné, S. et al., Dev. Growth & Differ. 25, 381-391, 1983, Toné, S. et al., Dev. Growth & Differ., 30, 261-270, 1988, Toné, S. et al.,. Hormone Res., 48, 5-10,1997)。これで指の間が分かれるのは指間細胞死であることが証明できた訳です。
生命研を10年勤めた後は、和歌山県立医大の生化学教室に移りましたが、もちろんそんな細胞死の研究を続行させてもらえる状況ではありませんでした。ただ分子生物関係のセットアップが皆無に等しい研究環境をなんとか使えるようにしたのはいい経験でした。数年後に(だんだん国内でもアポトーシスという名前が概念とともに知られてきたこともあり)理解ある上司の許可がおりて、細胞死研究を再開できました。指間組織の培養にも成功し、カスパーゼの阻害剤が半分程度しか指間細胞死を抑えないことから、指間細胞死はカスパーゼ非依存性の経路を含んでいることをCold Spring Harbor Meetingで発表しています。
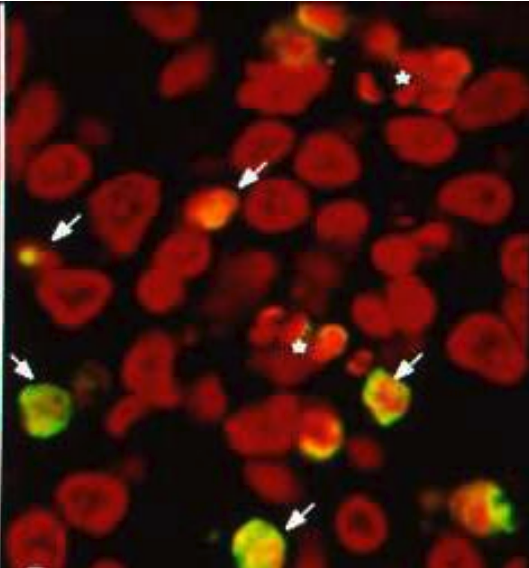
またどの遺伝子の発現のON/OFFが細胞の死ぬか生きるかの運命を支配しているかを知るために、BrdU処理胚と対照胚で比較しました。その時々の最先端の手法、DifferentialDisplay, Subtractive クローニング, 2次元電気泳動、マイクロアレイなどを使いましたが、結局絞り込めませんでした。
そうこうするうちにBMPシグナリングが指間細胞死に必須であることが報じられました。私たちはTUNEL法を指間細胞死に適用し、苦労してDNAラダーの検出もできましたので指間細胞死もアポトーシスであると報告しました (Toné, S.et al., Exp. Cell Res., 215, 234-236, 1994)。ところがその後、指間細胞死は、やはりアポトーシスで起きているのは半分程度で、残りは他の死に方で死んでいるというのが出ました(Chautan, M., et al. Curr. Biol., 9, 967–97, 1999)。BrdU処理では指間細胞死をほとんど抑えてしまいますので、もっと上流に作用していると思っています。最近では、指間の細胞死はほとんどない両生類と細胞死する羊膜類を進化的な視点から考察し、環境中の活性酸素がこの上流として働くことを東京工大の田中幹子博士のグループが見いだしています (Cordeiro, et al., Dev.Cell, 50, 155-166, 2019)。発生過程での活性酸素の役割は最近のトレンドとはいえ、進化の視点からそこに気づかれたのは非常に素晴らしいと思います。
ニワトリ肢芽の細胞死を研究している際にやはり目を引いたのが核の凝縮でした。M期染色体とは異なるものの同じくらい凝縮しています。しかし、三日月型もあれば小さく固まったものもあり、細胞ごとにバリエーションがあるのかもしれないとずっと思っていました。そしてどういう仕組みで核が凝縮するのだろうか?M期とは違うのか、共通のメカがあるのか?そして、やがて、これらの疑問に答えを与えてくれる方法に出くわしたのです。県立医大から東京都の研究所に移って、肢芽の細胞死とともに放射線や温熱による細胞死に興味を拡げて、発生だけでなく、より広い視点で細胞死を見つめようという研究環境に影響されたのかもしれません。ちょうど、三菱生命研で米国ジョンスホプキンス大のBill Earnshaw博士という方がセミナーをされて、単離核を使ったアポトーシスの凝縮の話をされたよ、という情報を耳にしました (Lazebnik YA, et al. J. Cell Biol., 123, 7-22,1993 )。論文を読んでみて、これはすごい、ぜひやってみたいと思い、すぐビルにFAXで問い合わせましたら、うちでは基本、技術は留学してきた人にしか教えないよ、とのお返事でした。紆余曲折、2回のインタビューに合格の後、3年後にビルのラボ(英国エディンバラ大に移籍)に留学することになりました。すでに私は40を越えていました。cell-freeの核凝縮の系は素晴らしく、DNA分解とカスパーゼの核凝縮における役割について様々なことが明らかになってきました (Samejima, Toné et al., J. Cell Biol. 143, 225-39,1998)。研究も楽しかったですが、やはり日本とは違う文化に触れることができたのは、私にとってかけがえの無い経験だったと思います。この技術を持ち帰り、倉敷にある川崎医大に赴任しました。単離核の凝縮をムービーに撮りましたが、当初、共焦点顕微鏡で撮影し、何度やっても途中で停まってしまいました。大阪府立大の杉本憲治教授が持っておられる技術のおかげで、個々の核の凝縮像を追跡できるようになり、核凝縮が試験管内では30分足らずの間に 3つのステップの順に進むことを見つけたのです。

まず数分以内に核がリング状になり、次にそのリングが切れてビーズ状になり(ネックレス)、最後にそのビーズが核の中心に激しく集まる。つまり、核凝縮には一定の順番(まさにプログラム)があり、in vivoで色々な凝縮像が見えたのは、細胞死が同調していないからです (Toné S, et al., Exp. Cell Res. 313, 3635-44, 2007)。細胞の種類によっては途中までしか、いかないものもありますが、おおむねアポトーシスにおける核凝縮はこのように進行すると思います。昨日、某○○○バイオのカタログを見ておりましたら、私たちが提唱する核凝縮のスキームそっくりの図が無断で載っていました。そしてこのcell-freeの系を使って、核凝縮に必須の因子を追い求めています。最後に激しくビーズが核の中心に集まるには、ATPが必要であることが判明しました。また、光学や放射線の専門の方達と、この凝縮しつつある核を対象にしてX線顕微鏡でイメージングする試みをこの10年余り続けてきました (Shinohara K, Toné S, et al., Cells, 8, 164;doi:10.3390/cells8020164, 2019)。
最近、とても不思議なデータを得ました。赤外の吸収スペクトルの解析によって、核凝縮の第 1 歩目、リング凝縮の時に核の DNA の立体構造に変化が起き、どうも A 型などの non-B 型 DNA が急増するようです。このリングになるステップは数分で起こり、DNA 分解は伴いません。しかし DNA の 3D 構造が急変するとすればうなづけます。このように異なる分野や技術を持った方たちとコラボすると、私たちを異次元の世界が待っているのかもしれません。
この他、精子形成と、トリプトファン代謝の研究も続けていますが、東京電機大学に移ってからは、若返る動物 ベニクラゲの研究を始めています。実は、この若返りの仕組みの黒幕としてアポトーシスが動いていると考えています。まだまだ研究レベルとしては、20 世紀真ん中くらいですが、やっと細胞単位で解析できるようになりましたので、自分がアポトーシスする前に、若返りの謎を解明したいと思っています。
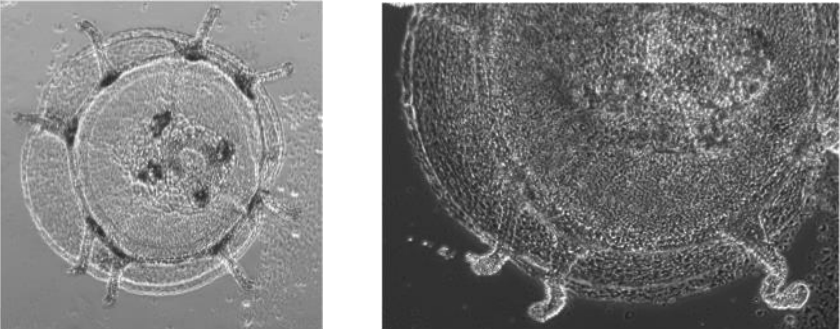
ベニクラゲの位相差像(左)とその強拡大画像(右)
老化したクラゲ個体をすりつぶすと団子状の塊となり、そこからポリプがのび、若いクラゲが出現する

著者プロフィール
1976 年 名古屋大学理学部生物学科卒業
1978 年 同 理学研究科(分子生物学)修士課程修了
1978〜88 年 三菱化成生命科学研究所・研究員
1988 年 理学博士(名古屋大学)
1988〜95 年 和歌山県立医大・生化学・助手
1995〜98 年 東京都臨床医学総合研究所・主任研究員
1997〜98 年 英国エディンバラ大学・客員研究員
1998〜2016 年 川崎医大・生化学・准教授
2016 年〜 東京電機大・理工学部・生命科学系・特任教授

