No.1 論文の面白さと研究者の理想の育成方法とは
中野 裕康 東邦⼤学医学部⽣化学講座
1) はじめに
そう⾔えば学⽣時代から順天堂⼤学の助教として働きだした頃まで、引退したら晴耕⾬読の⽣活をして⼩説を書くのが夢だと周囲の⼈たちに時々⾔っていたような気がする。そんな発⾔の背景には、ある時期に集中して特定の⼩説家の本を読んできたという習慣があった。本来⼩説を読むことを⼤事な趣味の1つとしていたこともあり、⼤学院に⼊学して基礎研究の優れた論⽂を読んでから、「優れた論⽂は⼩説を読むよりも⾯⽩いし、かつ論⽂を書くということは1つの物語を作ることだ」と考えるようになっていた。また最近ではラボメンバーにはこの事を積極的に伝えるようにしている。優れた論⽂を読むことが、優れた⼩説を読むことよりも⾯⽩いと感じるのは、私だけではないと思う。
2) ⾯⽩い論⽂とは
それではどのような論⽂が⼩説より⾯⽩いのであろうか?40 年ほど前に團伊玖磨⽒の「パイプの煙」というエッセイ集を読んでいた時のことを思い出した。そのエッセイ集の中に「釣りをしている⼈」に寄ってくる⼈には2 種類の⼈間がいるという話が出てくる。1つは「釣りそのもの」に興味のある⼈であり、このタイプの⼈は「何が釣れますか」と聞く。⼀⽅で「釣りをしている⼈」に興味のある⼈は、「釣れますか」と聞くらしい。このようなことはサイエンスにも当てはまるかもしれない。サイエンスが好きな⼈たち(少なくともサイエンスに興味を持っている学⽣)には2つのタイプがあるような気がしている、1つはサイエンスそのもの(つまり研究や研究すること)が好きな⼈であり、もう1 つはサイエンスをしている研究者に興味がある⼈である。私が今回なぜDavid G. Schatz による⼀連の論⽂(1-3)とそれについてのエッセイ(4)を紹介しようとするのかというと、これらの論⽂が遺伝⼦再構成に関与するRecombination Activating Gene (RAG)1 とRAG2 と命名した遺伝⼦を同定したという歴史的な発⾒ということだけではなく、この発⾒がPhD を取得する前の2 ⼈の⼤学院⽣によって成し遂げられたという、誰が聞いても興味をそそられる話であるということが⼤きな理由である。
またこのクローニングのエピソードの中には我々がラボで直⾯する様々な問題や、研究の醍醐味、あるいは本来のメンターと指導される⼤学院⽣との理想的な関係を読み取ることができる。周囲のうまくいかないだろうというアドバイスにも関わらず無謀とも思えるプロジェクトをスタートさせた勇気や、周囲のポスドクの冷ややかな視線にもかかわらず、楽観的にかつユーモアを持って研究を黙々と継続して⾏ったSchatz ともう1 ⼈の⼥性の⼤学院⽣(Marjorie A. Oettinger)の精神⼒の強さ、それと彼らの研究をサポートしたメンターのDavid Baltimore 博⼠との理想的な関係があったと思われる[Schatz のエッセイ(4)からは、メンターのBaltimore 博⼠がどの程度彼らの研究をサポートしていたかを読み取ることはできないが、少なくともこのリスキーなプロジェクトを中⽌させなかったこと、おそらく彼らの要求に応じて研究に必要な様々な試薬(ベクター、特殊な⼤腸菌や細胞など)を他の研究者から⼊⼿してくれていたことが推測される]。また2 ⼈がPhD を取得すると同時に他の⼤学で独⽴した研究者としてのポストを得て(おそらくいくら⽇本で優秀な⼤学院⽣でも、博⼠課程を修了してすぐに独⽴したポストにつくということはほぼ可能性がないと思われる)、現在も2 ⼈はそれぞれYale ⼤学とHarvard ⼤学で現役の教授として、RAG 遺伝⼦の研究を継続している。
本エッセイでは、まずRAG1 とRAG2 遺伝⼦のクローニングのあらましを紹介し、このエピソードから私が何を考え、我々のようなメンターが将来独⽴しようとする研究者をどのように教育していけばいいのかについて述べていきたい。
3) RAG1 の遺伝⼦クローニング
ハーバード⼤学医学部の学⽣であったSchatz が、Massachusetts Institute of Technology(MIT)のWhitehead Institute for Biomedical Research のBaltimore 博⼠の研究室でPhD 取得のための研究を開始したのは1985 年であった(ちなみに私が⼤学の医学部を卒業したのは1984 年であり、1984-1985 年の2 年間は周囲の同級⽣と同じで、いちじるしく効率の悪い国⽴⼤学医学部の付属病院で臨床研修を⾏なっていた)。1970 年代後半にはすでに利根川進博⼠が抗体遺伝⼦で遺伝⼦再構成が起こることを証明しており、その遺伝⼦再構成を担う酵素を同定しようと世界中の研究グループがしのぎを削っていた時期であった。遺伝⼦再構成という複雑なステップを担う酵素は、当然のごとく単⼀の酵素により担われていると考えにくく、タンパク質の精製を指標とした酵素同定の試みや、サブトラクション法でリンパ球特異的に発現する遺伝⼦を同定する⼿法などが⾏われていたものの遺伝⼦の同定はうまく⾏っていなかった。Schatz はこのような状況の中でBaltimore 研究室でV(D)J recombination [V(D)J 遺伝⼦再構成]に関与する遺伝⼦(後にRAG1 およびRAG2 と命名)を同定するという無謀なプロジェクトをたった⼀⼈で開始することになった。
彼にとって幸運だったのは、まず①研究室の別の⼤学院⽣がちょうどその前年に、Vk-Jk遺伝⼦の中に抗⽣物質耐性遺伝⼦を逆向きに挿⼊した⼈⼯的な遺伝⼦断⽚を、遺伝⼦再構成の起こっている細胞に導⼊すると、遺伝⼦再構成に伴い抗⽣物質耐性遺伝⼦が順向きになり、抗⽣物質の耐性を獲得するというアッセイ系を確⽴していたことであった (5)(図1)。 2 番⽬の幸運は、②ポスドクの⼀⼈が、ラボミーテングで抗⽣物質耐性遺伝⼦を逆向きに⼊れた発現ベクターを導⼊した細胞を⽤いれば、V(D)J 遺伝⼦再構成に伴い抗⽣物質耐性が出現するので、このことを指標にしてV(D)J 遺伝⼦再構成に関与する遺伝⼦のスクリーニングができるのではないかというアイデアを出したことであった。そこで彼はB 細胞由来のゲノムDNA を遺伝⼦再構成の起こっていない線維芽細胞に導⼊することにより、同定するという戦略を取ることにした。後にわかることだが、3 番⽬の幸運は③彼が外来遺伝⼦の導⼊⽅法としてcDNA ライブラリーをtransfection する⼿法をとったのではなく、ゲノムDNA のtransfection を⽤いたことであった。ここまでで少なくとも3 つの幸運が重なったことになる。
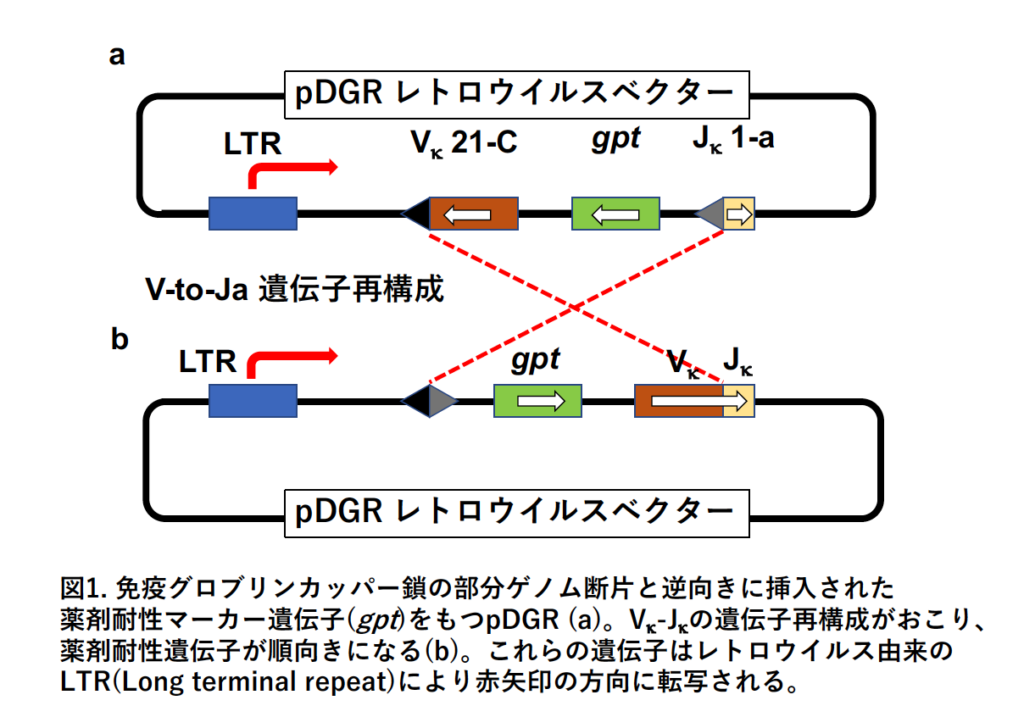
4) ゲノムDNA transfection によるV(D)J 遺伝⼦再構成活性を持つ遺伝⼦座の同定
線維芽細胞でV(D)J 遺伝⼦再構成を起こさせるためには、当然V(D)J 遺伝⼦再構成が起こっているリンパ球で発現している1個あるいは2 個以上の遺伝⼦が導⼊されることが必要だと容易に想像がつく。ここで重要なのは、1個なのか、2個以上なのかであり、仮に1個であるならば通常⾏われるcDNA ライブラリーのtransfection で遺伝⼦を取ることが可能である。しかし仮に2個以上の遺伝⼦が必要であるならば、cDNA ライブラリーのtransfection による相補的スクリーニングで遺伝⼦を同定することはほとんど不可能に近い。なぜなら少ない頻度でしか存在しないであろうV(D)J 遺伝⼦再構成に関与する2個以上の遺伝⼦が、偶然にも1個の細胞に導⼊される確率は、天⽂学的に低い数字だからである。V(D)J 遺伝⼦再構成という複雑な現象を考えると、当然のごとく単⼀の遺伝⼦だけでこの現象を誘導できるなどと考えるのは妄想に過ぎないと思われていた。このような状況の中で、メンターの保守的なアドバイスを無視して、David G. Schatz は遺伝⼦導⼊による相補的スクリーニングをスタートさせることになった。今から考えると最も幸運だったのは、前述したように彼がcDNA ライブラリーのtransfection ではなく、その当時隣のラボ(オンコジーンの研究で有名なRobert A. Weinberg 博⼠の研究室)でよく⾏われていたゲノムDNA(〜100 kb サイズのDNA)のtransfection 法を⽤いたことであった。もしSchatz がcDNA ライブリーのtransfection を⾏なっていたとするならば、決して成功していなかったであろう。なぜなら結果的にはV(D)J 遺伝⼦再構成を誘導するには1個の遺伝⼦では不⼗分で、RAG1 とRAG2 と命名された2個の遺伝⼦が必要であり、cDNA ライブラリーのtransfection で同⼀の細胞にこの2 つの遺伝⼦が⼊る可能性は限りなく低かったからである。このように幸運もあってSchatz はゲノムDNA のtransfection によりV(D)J 遺伝⼦再構成の活性を有する1 つの遺伝⼦(正確に⾔えば1 つのゲノムの遺伝⼦断⽚あるいは遺伝⼦座)を同定することができた (1)。
5) RAG1 遺伝⼦の同定
途中からMarjorie A. Oettinger という⼤学院⽣がこのプロジェクトに参加し、彼⼥の存在があって初めてRAG1 遺伝⼦の同定と、それにひき続くRAG2 遺伝⼦の同定という歴史的な発⾒がなされることになる。この歴史的な発⾒がポスドクでもない、2 ⼈の⼤学院⽣により成し遂げられたわけである。2 ⼈は常に楽観的でありかつユーモアを持ちつつ、様々なクローニング⼿法を試みていった。⼀⽅でその当時のラボの周囲の⼈たちの雰囲気は、決して2 ⼈の研究に対して好意的なものではなかった。その当時の周囲の雰囲気を隣のラボのポスドクの発⾔「すると君が例のアーチファクトの論⽂をCell に発表した⼈なんだ」が端的に表しており、多くの⼈たちは「彼らはありもしない架空の遺伝⼦を追いかけている」と考えていた。
もっとも困難だった点はゲノムの中から、transfection により導⼊されかつV(D)J遺伝⼦再構成に関与するゲノム断⽚を⾒つけ出すことであった。様々な⽅法が試された後に、transfection に使⽤するゲノム DNA にオリゴヌクレオチドタグ(⼈⼯的に合成した数⼗塩基からなる⽬印)を付加し、さらに遺伝⼦組換え活性の⾮常に低い特殊な⼤腸菌をホストとして⽤いることで、V(D)J 遺伝⼦再構成活性を有する導⼊されたゲノム断⽚の⼀部をクローニングすることができた(図2)。そこからgenomic walk をする(当時は現在のようにヒトゲノムは解読されておらず、どの染⾊体のどの場所にどのような遺伝⼦が存在するかもわかっていなかった)ことにより、最終的には遺伝⼦を同定し、塩基配列を決定することに成功した(図2)。この遺伝⼦はリンパ球やV(D)J 遺伝⼦再構成の活性の⾼いtransfectants でmRNA の発現が⾼いことも確認され、Recombination Activating Gene(RAG1)と命名された (2)。
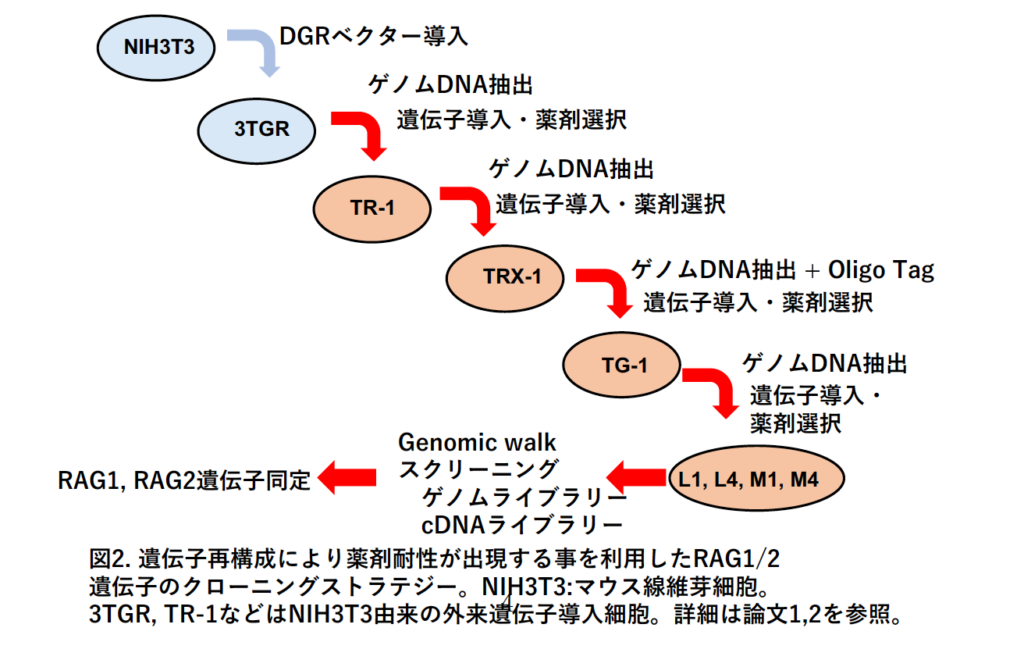
6) RAG2 遺伝⼦クローニング
RAG1 遺伝⼦の同定だけでは話は終わらなかった。RAG1 遺伝⼦を発現させるだけでは、⾮常に弱いV(D)J 遺伝⼦再構成活性しか誘導できないことが判明し、2 ⼈は再び混迷へと突き落とされた。その後様々な可能性が検討された結果、驚いたことにRAG1 遺伝⼦の近傍(数キロベース離れた場所)に第2 の転写ユニットが存在していることが明らかになった(図3)。この遺伝⼦をRAG1 と同時に発現させることで、V(D)J 遺伝⼦再構成活性が⾮常に強く誘導されたことからRAG2 と命名され、遺伝⼦再構成にはRAG1 とRAG2 の2つの遺伝⼦は必要であることが初めて明らかとなった (3)。2⼈はその後PhD を取得してMIT を去り、かつ医者になることをやめてそれぞれ独⽴した研究室を持つことになった。
7) RAG1 とRAG2 遺伝⼦の進化
何故RAG1 とRAG2 遺伝⼦が⾮常に近接してゲノム上に存在してるのであろうか?これは単に天⽂学的な偶然が重なっただけなのであろうか?不思議なことにRAG1 とRAG2 遺伝⼦の中でタンパク質をコードする領域は、単⼀のエクソンから構成されていた。マウスRAG1 およびRAG2 タンパク質がそれぞれ1008 個および527 個のアミノ酸から構成されていることを考えると(図3)、このような⽐較的⼤きなタンパク質が単⼀のエクソンから構成されるのは珍しいことだと思われる。その後の研究で驚くべくことが判明した。
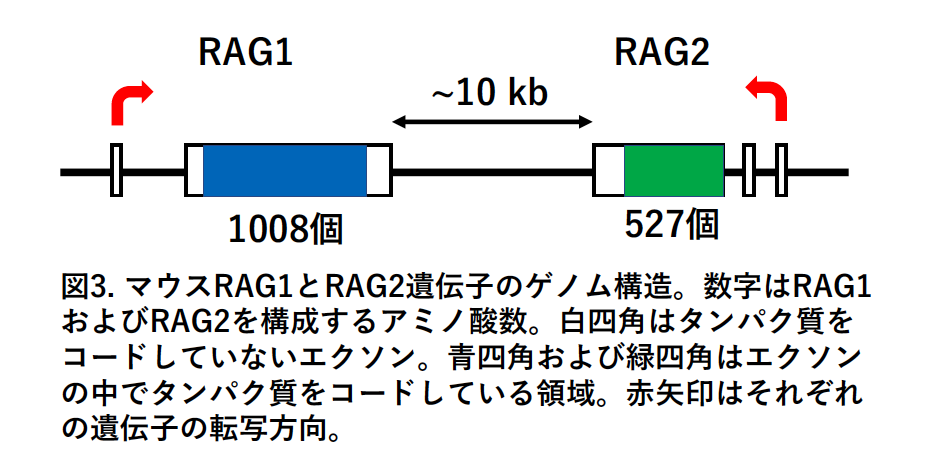
2つの遺伝⼦は、ヤツメウナギなどの無顎類(Jawless vertebrates)には存在せず、顎を持つ脊椎動物(Jawed vertebrates)には存在することから、進化の過程で外部から⼊ってきたトランスポゾン由来の遺伝⼦であると考えられた。当初はRAG1 とRAG2 遺伝⼦の両者がトランスポゾン由来の外来性の遺伝⼦と考えられていたが、最新の研究から、宿主にもともと存在していたRAG2 様遺伝⼦の近傍にトランスポゾン由来のRAG1 様遺伝⼦が⾶び込み、両⽅の遺伝⼦が進化の過程でそのまま保持されたと考えられている (6)。また現在ではナメクジウオなどの頭索動物(Cephalochordates)やウニなどの棘⽪動物(Echinoderms)にもRAG1 様遺伝⼦とRAG2 様遺伝⼦が存在することが明らかにされている。この2 つの遺伝⼦により、我々の細胞は遺伝⼦再構成を起こし、膨⼤な数の抗体遺伝⼦やT 細胞受容体遺伝⼦を準備することができるようになったとすると、我々は何と巧妙に進化してきたのだろうと想をめぐらさずにはいられない。
8) このエピソードから我々は何を学べるか?
RAG1 とRAG2 遺伝⼦のクローニングは単に幸運が重なっただけだろうか?研究のキーワードとしてよく出てくる⾔葉に、Serendipity (セレンデイピテイ)という⾔葉がある。この⾔葉の定義は、「⽬的のものをみつけようとしていて、偶然にも⾒つけようとしていたもの以上に重要なものを発⾒する事。あるいは⾒つけようとしていたものが、まったく別の⽅法でみつかる事。」というようなものである。David G. Schatz らの遺伝⼦クローニングのハイライトはやはり、最初に同定したRAG1 遺伝⼦の数キロベース離れたところに、V(D)J遺伝⼦再構成活性を発揮するために必要なもう⼀つの遺伝⼦(RAG2)が存在していたことであることは間違いない。普通ある特定の酵素活性を発揮するのに必要な2 個の遺伝⼦が、ゲノム上の近傍に存在する確率は、遺伝⼦重複などによって遺伝⼦数が増える場合などを除くと⾮常に低いはずである。また、ゲノムDNA のtransfection を⽤いなければ、RAG1とRAG2 遺伝⼦の同定はうまくいかなかったであろう。しかしこのようなことを考慮しても、彼らの仕事が単なる幸運の積み重ねの結果であるとは私は考えない。Serendipity についての著書のあるMorton A. Meyers は「Serendipity は、予想と反する結果が出た時にその結果をバイアスをかけずに⾒る洞察⼒と、予想外の結果の価値を⾒抜く能⼒が必要である。」と述べている (7)。2 ⼈のエピソードは⾃分たちの実験結果を信じ(私は常々「⾃分のデータを⾃分で信⽤できないのであれば、他⼈に⾃分のデータを信⽤させることは絶対にできない」と思っている)、常に楽観的に振る舞い、かつ周囲のnegative な意⾒や雰囲気をものともせず(positive な意味での鈍感⼒)、果敢に挑戦することの重要性を物語っている。
またこのエピソードは、優秀な⼤学院⽣あるいはポスドクを指導する場合には、いい研究テーマを与え、その後は⾃分の好きに研究をやらせ、アドバイスを求められたときに適切なアドバイスをすることがメンターとしての仕事であるということを⽰していると思う。往々にして⽇本の研究室(外国でもそのような研究室は多数あると思うが)では⼤きなテーマを複数の⼤学院⽣、ポスドクにやらせて⼤きな論⽂を執筆するというスタイルが存在する。確かにそのようなスタイルの⽅が効率的に論⽂を量産できるかもしれない。しかし、将来的に⾃⽴できる研究者を育成するには、みんなが同じ⽅向を向いているという⼀⾒効率的なラボ運営をするのではなく、極論すれば研究テーマだけを与えて好き勝⼿に実験をさせるのが、最も⾃⽴性がありかつ独⽴性を有する研究者を育成する⽅法ではないかと思えてくる。
9) ⾃分の研究⽣活を反省すると
それでは⾃分のこれまでの研究⽣活を考えてみて、何が良くて何が悪かったのであろうか。私は医学部を卒業し、その後5年間臨床医として働き、2年間病理を勉強するために研究所に勤務し、その後に分⼦⽣物学を学ぶために⼤学院に⼊学した。⼤学院時代の4年間は教授のメインプロジェクトとは異なった仕事をやっていたこともあり、⾃分でもやっている研究がそれほど重要な研究だという実感もなく、かつ満⾜できる論⽂や研究成果を得ることなく過ごした。今から思うとこの4年間は、⾃分の⼈⽣の中で最⼤の危機だったと思う。努⼒が報われる臨床医としての⽇々と決別して、基礎研究を始めて⾒たところ、⽇々の努⼒にも関わらず実験は遅々として進まず、⾃分の実験の不備を徹底的に批判されるという、これまで私の⼈⽣の中で経験したことのない⽇々であった。毎週⾏われた個別の討論では、陽性コントロールと陰性コントロールが必要なことを徹底的に教え込まれた。またどれだけ考えても、⾃分の仮説が間違っていれば陽性の結果が得られないことを⾝にしみて感じることができた。この時期のトレーニングは医学部卒で、基礎的なトレーニングを受けていない⾃分にとっては、修⼠課程でのトレーニングをしていたようなものだったのかもしれない。しかし、その中でも数少ない実験の喜びを経験できたことが、その後の⾃分の研究⽣活に繋がっていると思う。
その後私が助教として赴任した当時の順天堂⼤学医学部免疫学教室は、国内留学⽣、⼤学院⽣、スタッフなどが⼊り混じっており総勢で40〜50 ⼈ほどの⼤規模なラボであった。⼈数の割には実験スペースは⾮常に狭いラボであり、ラボの雰囲気はカオス的な状況であった。赴任した当時はとんでもない研究室に来てしまったと後悔する毎⽇であったが、今から思うと奥村研のスタイルは、早くからメンターに頼らずに独⽴した研究者としての⾃覚を持つという意味では、私にとっては良かったのかもしれない。私がこれまで⼤学院⽣やポスドクを指導してきて反省しなくてはならない点は数多い。例えば、実験をなるべく早く進めるために、本⼈の⾃主性を無視して無理やりある⽅向で実験をやらせた場合が多々あり、このような場合には、ある程度実験は進むかもしれないものの、予想外の発⾒に遭遇する可能性はほぼゼロであり、結局のところ予想した以上の実験結果は得られなかった。また指導した⼤学院⽣や博⼠研究員を⾃⽴した研究者として育成することができたかについては、甚だ疑問が残る。如何に⾃主性を持って実験をやらせるか、その中で予想した結果と異なる結果が出た場合に、その実験結果を何のバイアスもかけずに素直に解釈して、次のステップにいけるかが最も研究者にとって肝⼼な点だと思っている。
10) ⼤学院時代に何を学ぶのか
それでは研究者として独り⽴ちできるだけの考え⽅をいつ⾝につけることができるのであろうか?これを⾝につけられるとしたら修⼠課程の時期、あるいは博⼠課程でしかあり得ない。しかし、現在の少なくとも医学部の博⼠課程の場合には、この研究者の考え⽅を⾝につけるというような本来の⽬的よりも、とりあえず何でもいいから論⽂を⼀つ筆頭著者で執筆して博⼠号を取得したいという⼤学院⽣が多い。ノーベル医学賞を受賞したG タンパク質共役受容体の研究で有名なRobert J. Lefkowitz 博⼠は、コーベルメダル賞を受賞した時の講演で、医者になってからNational Institute of Health で2年間初めて研究に従事した時のことを以下のように述べている (8)。「それまで医学部の学⽣時代から、実験というものを避けてきた私は、基礎的な実験の知識も経験もなく、実験は失敗の連続であり遅々として進まなかった。そのような状況で私は2 ⼈の優れたメンターに巡り合った。⼀⼈のメンターは、私のことを⿎舞してやる気を出させてくれ、⼀⽅でもう⼀⼈のメンターは私の実験に適切なコントロール実験のないことを容赦無く指摘し、結論を導き出すことのできない実験だと徹底的に批判し、常に私を奈落の底につき落とした。」。彼のそれまでのプライド(彼は成績優秀で⾶び級をしていた)は⽊っ端微塵に打ち砕かれたが、2年間の研究⽣活は、彼の⼈⽣を⼤きく変えることになった。その後のMassachusetts General Hospitalでのクリニカルフェローとしてのトレーニング期間に、彼は「実験結果⽋乏症」(このような病気はないと思う)に陥り、本来「クリニカルフェローは実験に従事してはいけない」と⾔う内規を破ってまで実験を⾏い、その後⽣涯を研究に捧げることになった。多⽥富雄先⽣(私のメンターの奥村康教授も斎藤隆教授も多⽥先⽣の弟⼦であり、私は孫弟⼦に当たる)の恩師である⽯坂公成博⼠が⼤学院時代の教育で最も重要なことは、「インパクトの髙い雑誌に論⽂を書くことではありません。最も重要なのは⼀⼈⽴ちできる研究者になるための基礎となる科学的考え⽅を⾝に着けることです。」と⾔うことを述べている (9)。
11) 理想的な研究者の育成⽅法とは?メンターは何をしてはいけないのか?
以上を総合して考えると、理想的な研究者の育成⽅法とは次のようなことになるのではないだろうか。修⼠課程や博⼠課程の最初の2年間程度は、徹底的に実験の基礎(なぜこのコントロール実験が必要なのかなど)および⾃分の⾏っている実験の意義について、深く考えさせるトレーニングをすることだろう。また批判的に論⽂を読むことのトレーニングも重要だと思う。これらのトレーニングを通じて要求される⽔準に達しない学⽣(つまり主体的に⾃分で考えることのできない学⽣)は、将来的に研究者として⾃⽴できる可能性は⾮常に低く、進路を変えたほうがいい。もちろんこの時期に論⽂を出す必要はないと思う。逆にメンターがこの時期にやってはいけないことは、ラボ全体として論⽂を量産するために、学⽣に実験の意味も説明せずに、⼤きなプロジェクトの中の⻭⾞として働かせ、無給の技術員のように扱う事ではないだろうか? 「頭を使わなくてもメンターの⾔うことに従っていれば、論⽂が出る」と⼤学院⽣が考えてしまうとしたら、このような指導は⼤学院⽣に対する教育としては最悪の「刷り込み」になってしまうと思う(私もそういう「刷り込み」をしていたのかもしれない)。
最初のステップをうまくクリアした学⽣には、次のステップとしてテーマを与えて時々適切なアドバイスを与えることはあっても、あとは⾃分の考えで実験を勝⼿にやらせることだと思う。⼤学院時代に⼤きな論⽂を完成させることに越したことはないが、研究者としての⻑い⼀⽣を考えるのであれば、その時のプロジェクトが失敗に終わっても全く問題はないと割り切った⽅がいい。もし本⼈が⾃⽴した研究者としての資質が⾝についていれば、⼤きな仕事ができるかどうかは運も関係してくるが、着実に仕事を成し遂げて⾏くことができるだろう。
12) You cannot connect the dots looking forward; you can only connect them looking backward
最近YouTube で、Steven P. Jobs (Steve Jobs)のStanford ⼤学での学位授与式のスピーチをたまたま聴く機会があった(https://www.youtube.com/watch?v=VyzqHFdzBKg)。彼はReed ⼤学という学費の⾼い私⽴⼤学に⼊学後にすぐ中退を決意したが、実際に中退するまでの間に⾃分の興味で、カリグラフのコースをとっていた。彼は「その当時は将来何の役に⽴つかわからなくて習得したカリグラフに関する知識が、10 年後に最初のMacintosh のパソコンの活字体を作成する時に突然蘇ってきた。もしカリグラフのコースを取っていなければ、Macintosh のパソコンは、今のような均等なスペースを有する美しい活字体を取り⼊れることはできなかっただろう。」という話をしていた。彼はその経験をconnecting the dots と表現しており、「将来を⾒据えてdots をつなぎ合わせることはできない、後からしかdots は繋ぎ合わせることはできない」と述懐している。
このことは誰にでも当てはまることだと思う。例えば私は⼤学院に進学する前に肺の病理の研究(私はもともと呼吸器内科の医者だった)をしたいと思い、所属していた呼吸器内科学講座の教授に直談判し、2年間清瀬の結核研究所というところで病理の研究員として働くことになった。しかしこの2 年間は私にとって筆頭著者の論⽂を1本も書くことができず、様々な⼈々にお世話になったものの、「このままここで免疫染⾊や病理解剖をやっていても病気の本体はわからない」という確信を得ただけだった。悶々とした⽇々を送る中で、私はある時、この閉塞状況を打ち破るには⼤学院に進学して、基礎研究をしなくてはならないという結論に達した。⼤学院進学後も、⼈⽣の中でこの2 年間にどの様な価値を⾒いだせるのだろうかとずっと悩んでいた。⼀⽅で私は⼤学院時代に主に培養細胞を⽤いた実験をしていたために、動物実験施設で感染が発⽣した時に、汚染した遺伝⼦改変マウスの世話をするという仕事が回ってきた。動物実験をしている⼈はクリーンなマウスを扱い⾃分の実験をしている中で、全くマウスの実験をしていない⼤学院⽣数名が汚染した環境に存在するマウスを維持するという教授の決定に対して、合理主義的な考え⽅の私は激しく反発を覚え、教授と⼝論になったのを覚えている。しかし⽪⾁なことに順天堂⼤学に赴任してまもなく⾃分の同定した遺伝⼦の遺伝⼦改変マウスを作成するというプロジェクトを⽴ち上げることになり、この時に遺伝⼦改変マウスを取り扱っていたことが思いもかけず役に⽴つことになった。さらに2010 年頃から細胞死の亢進した遺伝⼦改変マウスを⽤いた研究が私のグループの主な研究テーマとなった。病態モデルマウスの解析をする時になり、免疫染⾊や病理の基礎を学んだ清瀬の結核研究所での2 年間の経験が私の中に急に蘇ってきた。まさにJobs が⾔うように「dots は後からしか繋ぎ合わせることはできない」ということを⾝に染みて感じることになった。このことは「⼈⽣において本当に無駄なことなど何もなく、その時々で⾃分のベストを尽くしていれば、必ずいつかその経験が役に⽴つようになる。」と考えて毎⽇を過ごすことの⼤切さを⽰している。
13) 終わりに
⽇本Cell Death 学会はコロナ感染拡⼤のために、初めて学術集会を中⽌するという事態に⾄っています。学会として何のイベントも⾏わずに、会費だけを徴収するのは不適切だと考え、理事や⼀部の評議委員の⽅々に⼀連のエッセイの連載をお願いしており、私の記事もその⼀環です。コロナ感染拡⼤⾃体は本当に悲惨な出来事ですが、全ての学会や研究会などが中⽌になってしまった現在の状況は、もしかしたらサイエンスそのものをじっくり考える時間が増えている⼈もいるのではないかと思われます。コロナ感染拡⼤により様々な障害が⽣じている現状を、何とか乗り越えて⽇本Cell Death 学会員の⽅々の研究がさらに⾶躍することをお祈りいたします。またこの拙⽂が今後の⼤学院⽣教育の参考に少しでもなれば幸いです。
参考⽂献
Schatz DG, Baltimore D. Stable expression of immunoglobulin gene V(D)J recombinase
activity by gene transfer into 3T3 fibroblasts. Cell 1988;53:107-115.
Schatz DG, Oettinger MA, Baltimore D. The V(D)J recombination activating gene,
RAG-1. Cell 1989;59:1035-1048.
Oettinger MA, Schatz DG, Gorka C, Baltimore D. RAG-1 and RAG-2, adjacent genes that
synergistically activate V(D)J recombination. Science 1990;248:1517-1523.
Schatz DG, Baltimore D. Uncovering the V(D)J recombinase. Cell 2004;116:S103-106,
102 p following S106.
Lewis S, Gifford A, Baltimore D. Joining of V kappa to J kappa gene segments in a
retroviral vector introduced into lymphoid cells. Nature 1984;308:425-428.
Carmona LM, Schatz DG. New insights into the evolutionary origins of the
recombination-activating gene proteins and V(D)J recombination. FEBS J 2017;284:1590-1605.
Meyers MA. Happy Accidents-Serendipity in Modern Medical Breakthroughs-. New York:
Arcade Publishing, 2007.
Lefkowitz RJ. A tale of two callings. J Clin Invest 2011;121:4201-4203.
⽯坂 公茂. 我々の歩いてきた道. 東京: 黙出版, 2000.

著者プロフィール
1984 年 千葉⼤学医学部卒業
1989 年 財団法⼈結核予防会結核研究所病理 研究員
1995 年 千葉大学大学院医学研究科 博士過程(内科系)修了
1995 年 順天堂⼤学医学部 助教
2000 年 戦略的創造研究推進事業「さきがけ」PRESTO 研究員(兼任)
2001 年 順天堂⼤学⼤学院医学研究科 講師
2007 年 順天堂⼤学⼤学院医学研究科 准教授
2014 年 東邦⼤学医学部医学科 教授
ホームページ: http://tohobiochemi.jp


